

Strukturformel:
![]()
Andere Bezeichnungen: Carbid, Karbid, Calciumacetylenid, Calciumacetylid; engl.: Calcium carbide
| CAS-Nr.: | [75-20-7] |
| EG/EINECS-Nr.: | 200-848-3 |
| EG-Index-Nr.: | 006-004-00-9 |
| RID/ADR: | UN 1402 4.3/17b |
| Zolltarif-Nr. | 4849.10 |
Beschreibung
Bei der technischen Ware handelt es sich um graue, grauschwarze bis graubraune, eigenartig-unangenehm riechende Stücke oder Brocken, die beim Einwerfen in Wasser gesundheitsschädliche und hochentzündliche Gase mit dem Hauptbestandteil Acetylen entwickeln (diese Probe aus Sicheitsgründen nur mit etwa erbsengroßen Stückchen durchführen; Schutzbrille!). Die sich bildenden Gasblasen verbrennen beim Entzünden mit einer stark rußenden, leuchtenden Flamme. Im Wasser verbleibt dabei Calciumhydroxid (Bildung von Kalkmilch). Carbid ist unbedingt dicht verschlossen, vorzugsweise in Blechdosen, und trocken aufzubewahren. In reinstem Zustand tritt Calciumcarbid in Form farbloser, kristalliner Massen auf. Die graue Farbe des Handelspräparates rührt von Kohlebeimengungen her.
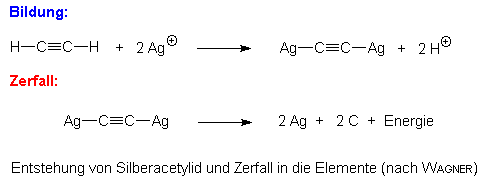
Acetylen oder Äthin, C2H2, weist zwar eine derart geringe Acidität auf, daß diese in wäßrigen Lösungen nicht in Erscheinung tritt. Trotzdem können die beiden Wasserstoffatome der Verbindung durch Metallatome (wie hier Calcium, aber auch Schwermetalle wie Ag, Cu usw.) ersetzt werden. Man spricht dann von Acetyleniden oder Acetyliden. Im Gegensatz zum Calciumcarbid besteht bei Silber- und Kupfer(I)-acetylid (wie bei anderen Schwermetallacetyliden!) die Gefahr einer heftigen Explosion, sobald diese in trockenem Zustand vorliegen. Mit Wasser reagieren die Schwermetallacetylide nicht, erst die Umsetzung mit verd. Salzsäure führt zur Hydrolyse.Folgendes Schema veranschaulicht die Bildung und den Zerfall von Silberacetylid (Azetylensilber):
Darstellung von Calciumcarbid
Laboratoriumsmäßig besteht eine Gewinnungsmöglichkeit in der Zersetzung von Calciumcyanamid durch Erhitzen im Vakuum und in Anwesenheit von Kohlenstoff. Die großtechnische Herstellung geht dagegen von den Grundstoffen Calciumoxid (Ätzkalk) und Koks (oder Anthrazit) aus, die im elektrischen Lichtbogen bei Temperaturen zwischen 1800-2100 °C nach der folgenden Reaktionsgleichung umgesetzt werden :
CaO + 3 CBei der Darstellung von Calciumcarbid entstehen auch Nebenprodukte (Calciumphosphid, Calciumsulfid, Siliciumcarbid, Eisenverbindungen, Calciumoxidreste usw.). Aus Calciumphosphid kann bereits durch geringe Feuchtigkeitsspuren Phosphorwasserstoff entstehen, welcher für den unangenehmen Geruch der technischen Carbidstücke verantwortlich ist.
Anwendung
Calciumcarbid wurde in früherer Zeit vielfach für Beleuchtungsaufgaben (Fahrradbeleuchtung etc.) in sog. Acetylen- oder Carbidlampen eingesetzt. Durch kontrolliertes Auftropfen von Wasser entsteht in der Lampe aus Carbid Acetylen:
CaC2 + 2 H2O ![]() C2H2 + Ca(OH)2
C2H2 + Ca(OH)2
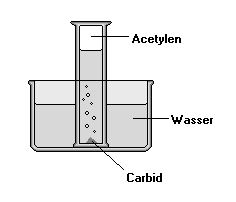
| Abb.: Labordarstellung von
Acetylen im Kleinmaßstab. Man füllt einen Standzylinder vollständig mit Wasser, verschließt mit einer Glasplatte und stellt ihn umgekehrt über einen in Wasser geworfenen, kleinen Brocken Carbid. Das Gas sammelt sich im Zylinder. Über die Gefährlichkeit von Acetylen siehe Abschnitt unten. |
 |
Diese Reaktion wird auch technisch zur Acetylenherstellung ausgenutzt; Acetylen findet verbreitet als Schweißgas (sog. Dissousgas) sowie wichtiges Ausgangsprodukt für organische Präparate Verwendung. Vor allem in Ländern mit großen Kohlevorkommen (z.B. Südafrika) lohnt sich die Nutzung von Acetylen als Synthesegrundstoff, während die Bedeutung von Acetylen und damit von Carbid in Westeuropa und Nordamerika aufgrund der guten Verfügbarkeit von Erdöl zurückgegangen ist. Aus 1 kg Carbid entstehen ca. 260 Liter Acetylengas.
| ! | Vorsicht,
Acetylengas ist leicht entzündlich und verbrennt an der Luft mit stark leuchtender,
rußender Flamme. Acetylen bildet mit Luft explosionsfähige Gemische (und zwar in einem
weiten Konzentrationsbereich, gilt für Mischungen mit einem Acetylengehalt zwischen 1,5
und 82%). Reines Acetylen kann sich bei normalem Luftdruck schon ab einer Temperatur von
160 °C unter Detonation zersetzen (vgl. auch J. Chem. Educ., Lit. 2). Daher ist es wichtig, Calciumcarbid stets trocken, dicht verschlossen und von Wohnplätzen entfernt zu lagern. Beim Umgang mit Calciumcarbid sind die Vorschriften zu Arbeitshygiene und Unfallvorbeugung streng zu beachten. |
Carbid ist auch verwendbar zur Herstellung von Calciumcyanamid, Ca=N-CN, einem Düngemittel mit Pflanzenschutzwirkung (sog. Kalkstickstoff). Calciumcyanamid entsteht aus Calciumcarbid durch exotherme Umsetzung mit Stickstoff (Azotierung) bei Temperaturen um 1000 °C. Als Zwischenstufe tritt dabei Calciumcyanid auf.
Quellenangaben/Literaturhinweise Calciumcarbid und Carbide, Acetylen, Acetylide:
[1] BEYER/WALTER, Lehrbuch der Organischen Chemie 19. Aufl., S. 96 (S. Hirzel, Stuttgart)
[2] J. Chem. Educ. 45, A 199 (1988)
[3] LATSCHA/KLEIN, Anorganische Chemie - Basiswissen I, S. 270 (Springer-Verlag, Berlin Heidelberg 1978)
[4] MERCK Index 12, 1696
[5] RÖMPP Chemielexikon Hrsg. Falbe/Regitz 9. Aufl., Band 1 A-Cl, S. 551f (G. Thieme Verlag, Stuttgart 1995) - Eintrag Calciumcarbid
[6] RÖMPP Hermann/RAAF Hermann, Organische Chemie im Probierglas 13. Aufl., S. 50 (Franchkh´sche Verlagshandlung, W. Keller & Co., Stuttgart 1975)
[7] WAGNER Georg, Chemie in faszinierenden Experimenten, 9. Aufl., S. 71 (Aulis Verlag Deubner & Co. KG, Köln 1997)
Chemikalienlexikon: Ethin

Die im vorliegenden Chemikalien-Lexikon enthaltenen Informationen dienen zu wissenschaftlichen Schulungszwecken. Sie sind nicht dazu bestimmt, irgendwelche Eigenschaften von Produkten oder deren Eignung für einen bestimmten Verwendungszweck zuzusichern. Die Benutzung der Informationen geschieht auf vollkommen eigene Verantwortung des Lesers. Jegliche Haftung für Schäden, Folgeschäden oder Verluste, die beim Umgang mit den hierin beschriebenen Stoffen oder Zubereitungen oder bei der Durchführung der im Lexikon enthaltenen chemischen Versuchsbeschreibungen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Mit dem Abrufen und Benutzen der Daten erkennt der Benutzer diese Bedingungen an.
Es wird ausdrücklich darauf hingewiesen, daß für den Umgang mit Gefahrstoffen zahlreiche gesetzliche Regelungen und Einschränkungen gelten. Chemikalien dürfen nur von Personen mit der erforderlichen theoretischen und praktischen Sachkenntnis unter Einhaltung aller national gültigen Vorschriften gelagert und verwendet werden. Die dem jeweiligen Stand der chemischen Wissenschaft und Technik entsprechenden Sicherheitsvorkehrungen, Unfallverhütungsrichtlinien und Maßnahmen zur Arbeitshygiene sind ebenfalls einzuhalten.
[Index] * [Homepage] Erstellt am 02.09.1999 * Letzte Änderung des Dokuments am 12.11.2000