![]()
![]()
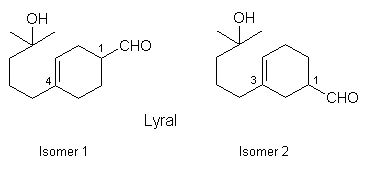
Andere Namen: 4-(4-Hydroxy-4-methylpentyl)-3-cyclohexen-1-carboxaldehyd bzw. 3-(4-Hydroxy-4-methylpentyl)-3-cyclohexen-1-carboxaldehyd (Handelsüblich ist eine Mischung dieser Isomere im Verhältnis 70:30); Kovanol (Takasago)
CAS-Nr.: [31906-04-4] bzw. [51414-25-6]
EWG-Nr.: k.A.
FEMA-Nr.: k.A.
Vorkommen:
Lyral kommt nicht in der Natur vor. Der Aldehyd wird synthetisch aus den Grundbestandteilen Myrcenol und Acrolein hergestellt (s. unten).
Chemische und physikalische Kenndaten:
Summenformel: C13H22O2
Strukturformel:
Molekülmasse: Mr 210,32 g/mol
Dichte: d420 0,9941
Brechungsindex: nD20 1,4915
Siedepunkt: bp0,13 kPa 120-122 °C
Beschreibung:
Klare, farblose bis blaßgelbe, viskos-ölartige Flüssigkeit, die gut in 70- und 96%igem Ethanol löslich ist.
Duft:
Lyral besitzt einen süßen, blütenhaften Duft mit ausgeprägter Maiglöckchennote und zählt aufgrund seiner ausgezeichneten fixierenden Eigenschaften zu den "upper-ten"- Riechstoffen der letzten 25 Jahre. Wie bei vielen Riechstoffen entfaltet sich der volle Dufteindruck erst bei Verdünnung.
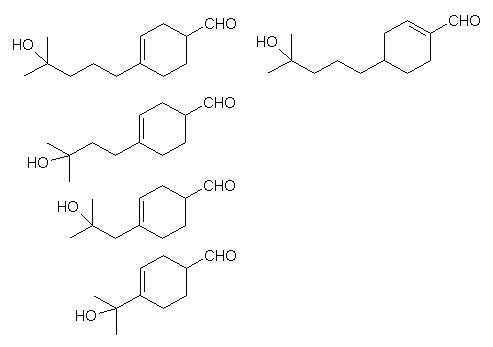
Interessant sind die Beziehungen zwischen chemischer Struktur und Duft verschieden substituierter Cyclohexen-Carboxaldehyde. Die oben beschriebene Geruchsqualität ändert sich bei stufenweiser Verkürzung der Seitenkette nicht wesentlich. Verschiebt man dagegen die isoliert stehende Doppelbindung derart, daß sie in Konjugation zur Aldehydgruppe steht, so verlieren entsprechende Lyralisomere die Dufteigenschaften vollkommen (Struktur rechts).
engl.: sweet, floral, reminiscent of lily of the valley
Verwendung:
Der Riechstoff läßt sich für Anwendungen in der Kosmetik- und Seifenparfümerie gleichermaßen einsetzen. Sein Duft ist sehr angenehm, seine Maiglöckchennote ausgeprägter als die von Hydroxycitronellal - mit dem Vorteil besserer Haftfestigkeit und höherer Stabilität in Seifen. Die Zugabe von Lyral verstärkt die blumige Note und bewirkt eine Abrundung von Parfümkompositionen (wie z.B. Muguet, Hyazinthe, Flieder).
Synthese:
Läßt man den Monoterpenalkohol Myrcenol mit Acrolein im Sinne einer Diensynthese nach DIELS-ALDER (unter Verwendung eines LEWIS-Katalysators wie Zinkchlorid) reagieren, so bildet sich folgender in 4-Stellung des Cyclohexen-Rings substituierte Aldehyd:
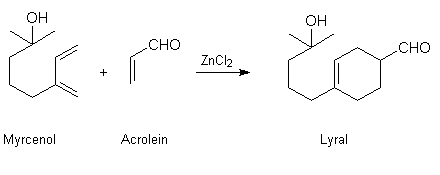
Vollzieht man die Umsetzung bei erhöhten Temperaturen, jedoch ohne die Zugabe des Katalysators, so bildet sich ein Gemisch aus in 4- bzw. 3-Stellung des Cyclohexenrings substituierten Aldehyden. Diese Mischung wird ebenfalls als Lyral im Handel angeboten.
![]()
![]()
Zurück zur Inhaltsübersicht